PCR技术----引领分子诊断的未来
在上篇说到,分子诊断是IVD行业中发展最快的细分领域,按照技术分类可将其分为核酸分子杂交技术、核酸扩增技术、基因芯片技术、基因测序技术四类。而PCR技术作为核酸体外扩增技术之一,以壁垒相对较低,国产化程度高,国内企业布局相对较早的优势占据分子诊断产品总产品量的70%以上。本篇将对PCR家族的常用技术展开简单介绍。
01什么是PCR?
PCR (Polymerase Chain Reaction)即聚合酶链式反应,是一种体外扩增特定DNA片段的分子生物学技术。PCR技术自问世以来,在生物科学领域、分子诊断领域、亲子鉴定、法医鉴定以及犯罪调查等方面发挥了巨大作用,是迄今为止最为重要的技术之一。
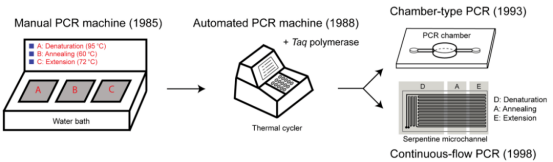
图1 PCR仪器的发展历程(来源:Lee NY., 2018[1])
经过演化和革新,PCR技术已经发展了三代:普通PCR技术、实时荧光定量PCR技术(qPCR)以及数字PCR(dPCR)技术。
02 PCR的原理
通过PCR技术可将目标DNA片段扩增一百万倍以上,其原理是在DNA聚合酶催化下,以母链DNA为模板,以特定引物为延伸起点,通过变性、退火、延伸等步骤,体外复制出与母链模板DNA互补的子链DNA的过程。
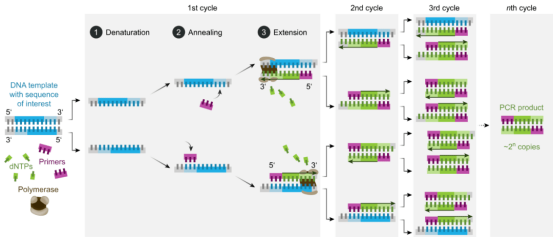
图2 PCR的基本反应步骤(来源:网络)
标准PCR过程分为三步:
1.变性(Denaturation):利用高温使模板DNA 双链分离。DNA双链之间的氢键在高温下(93- 98℃)被打断,解离成单链,以便与引物结合。
2.退火(Annealing):降低温度至55℃左右时,引物与模板DNA单链按照碱基互补配队原则结合。
3.延伸(Extension):再将温度调至DNA聚合酶最适反应温度72℃左右,DNA模板与引物结合物在Taq DNA聚合酶的作用下,按碱基配对与半保留复制原理,沿着磷酸到五碳糖(5'→3')的方向合成一条新的与模板DNA链互补的半保留复制链。往复循环这三个步骤25-35次,DNA片段数将得到指数级增加。
03 技术种类
实时荧光定量PCR
Quantitative Real-time PCR, qPCR
RT-qPCR是应用于以RNA作为起始材料的一种实验方法,结合了荧光定量技术的逆转录PCR技术。与一代PCR相比,实时荧光定量PCR作为二代PCR的优点主要体现在荧光、实时、定量。在PCR扩增反应体系中加入荧光探针,通过收集荧光信号实时监测每个循环中扩增产物量的变化,利用标准曲线和CT值对待测样品进行定量分析。常用的荧光物质可分为TaqMan荧光探针、荧光染料和分子信标。
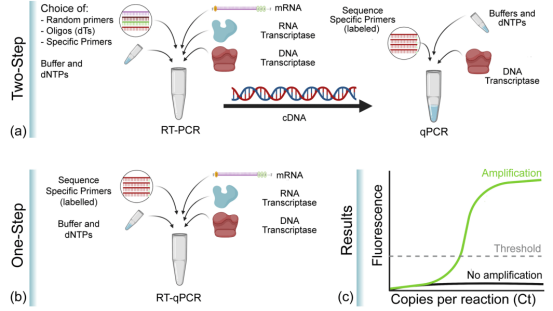
图3 RT-qPCR的一步法和两步法
(来源:Soler et al., 2020[2])
RT-qPCR已被用于多种分子生物学的应用中,其中包括基因表达分析、RNA干扰验证、微阵列验证、病原体检测、基因测试和疾病研究。RT-qPCR可通过一步法或两步法来完成。一步法将逆转录与PCR扩增相结合,使逆转录酶与DNA聚合酶在同一管内同样缓冲液条件下完成反应,此法只需要利用序列特异性引物。而两步法中的逆转录和PCR扩增过程是在两个管中完成,使用不同的优化的缓冲液、反应条件以及引物设计策略。
01
荧光探针法(TaqMan技术)
TaqMan探针是最早用于定量的方法,也是临床检测中最常用的检测方法。PCR扩增时,加入一对引物的同时再加入一个特异性的荧光探针。该探针为一寡核苷酸,5'端标记一个荧光报告基团(Reporter, R),3'端标记一个淬灭基团(Quencher, Q)。当探针完整时,报告基团发射的荧光信号被淬灭基团吸收,以至于无法检测到荧光信号;当PCR扩增时(在延伸阶段),探针会被Taq酶的5'→3'外切酶活性酶切降解,使报告基团和淬灭基团分离,报告基团发射底的荧光不会再被吸收,从而可以在荧光监测系统接收到荧光信号,即每扩增一条DNA,就形成一个荧光分子,PCR产物的形成与荧光分子的形成完全同步,PCR产物越多,荧光信号累积的越多,荧光强度越大。
此法检测特异性强、灵敏度高、适合进行多重qPCR检测,且PCR后续无需处理,节省时间和原料成本。但探针的水解依赖Taq酶外切酶的活性,定量时容易受试剂和酶性能影响,且淬灭难以彻底,本底较高;不仅需要根据不同的序列,合成不同的探针,检测结果还很难判断实际的扩增特性。
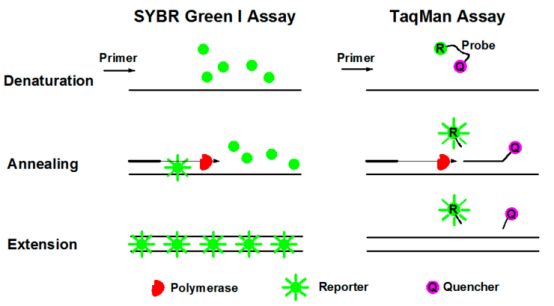
图4 荧光染料法(左)和荧光探针法(右)的qpcr原理
(来源:Cao et al., 2020[3])
02
荧光染料法(SYBR Green)
SYBR GreenⅠ是荧光定量PCR中最常用的荧光染料,能与所有的双链DNA结合。在PCR反应体系中,加入SYBR GreenⅠ,其会与过程中的双链DNA结合,产生荧光信号。因此,反应中荧光信号发增加与PCR产物的增加呈同步增长,荧光强度也随着产物的增加而增加。此法检测灵敏度高,价格相对较低,对DNA模板没有选择,通用性好,使用方便。但是由于染料与双链DNA是非特异性结合,因此可能产生假阳性的结果,需要通过熔解曲线分析识别扩增产物的特异性。与此同时,还需不断优化反应体系以降低非特异性扩增,不适合进行多重qPCR检测。
03
分子信标
是一种在5'和3'末端自身形成一个8个碱基左右的发夹结构的茎环双标记寡核苷酸探针,两端的核酸序列互补配对,导致荧光基团与淬灭基团紧紧靠近,不会产生荧光。
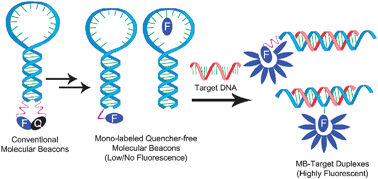
图5 分子信标工作原理
(来源:N. Venkatesan et al., 2008[4])
PCR产物生成后,退火过程中,分子信标中间部分与特定DNA序列配对,荧光基因与淬灭基因分离产生荧光。
等温扩增技术
Isothermal Amplification Technology
等温扩增技术是近年来发展起来的基于恒温扩增的新型核酸扩增技术,主要包括环介导等温扩增(Loop-mediated Isothermal Amplification, LAMP)、交叉引物扩增(Crossing Priming Amplification, CPA)、链替代扩增(Strand Displacement Amplification, SDA)、重组酶聚合酶扩增(Recombinase Polymerase Amplification, RPA)、依赖核酸序列的扩增(Nucleic Acid Sequence-based Amplification, NASBA)、滚环扩增(Rolling Circle Amplification, RCA)和依赖解旋酶的扩增(Helicase-dependent Amplification, HDA)。尽管各种等温扩增技术均采用恒温扩增,但引物设计与扩增原理差异较大,将对其中两种进行简述。
01
环介导的等温扩增
环介导等温扩增技术(Loop-Mediated Isothermal Amplification, LAMP)在60~65 ℃条件下进行,需要4条引物和具有链置换功能的嗜热脂肪芽孢杆菌DNA聚合酶(DNA polymerase of Bacillus stearothermophilus,BstDNA聚合酶)。外引物与PCR引物类似,而内引物则含有两段序列。过程如下:(1)内引物结合目的基因,在BstDNA聚合酶的作用下延伸为双链。外引物与双链DNA的5′端结合,在一端形成环状结构。另一端经过同样过程,形成两端为环的哑铃状结构。(2)哑铃状结构的单链DNA具有模板与引物的双重功能,在Bst聚合酶的催化下即能延伸。(3)内引物也能与环状结构结合,在酶的作用下进行延伸。
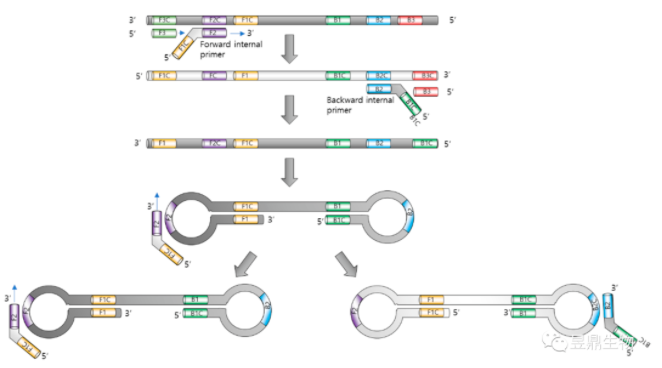
图6 环介导等温扩增原理
(来源:Park J-W et al.,2022[5])
02
基于转录的扩增
基于转录的扩增包括核酸测序扩增(Nucleic Acid Sequence-based Amplification,NASBA)和转录介导扩增(Transcription Mediated Amplification,TMA),两者都是通过RNA进行的等温扩增技术。
TMA是针对靶序列设计一对特异性引物,其中启动子引物上具有T7 RNA聚合酶识别的启动子序列,这一引物与靶序列结合后,在反转录酶的作用下进行反转录反应,形成 RNA-DNA杂交分子。反转录酶所具有的RNase H活性可以水解RNA-DNA杂交分子,形成单链DNA,该单链DNA含有 T7 RNA聚合酶识别的启动子序列。然后引物2与单链DNA结合,通过反转录合成双链DNA。T7 RNA聚合酶结合在启动子上,以DNA为模板进行转录,由一分子DNA模板可得到100~1000拷贝转录本,这些转录本又进入反应,作为TMA的起始模板,重复上述步骤。在TMA反应中,产物RNA呈指数增长,在15~30 min内可将靶序列扩增 1010左右[6]。反应完成后,可用杂交保护试验(Hybridization Protection Assay,HPA)对RNA产物进行检测。
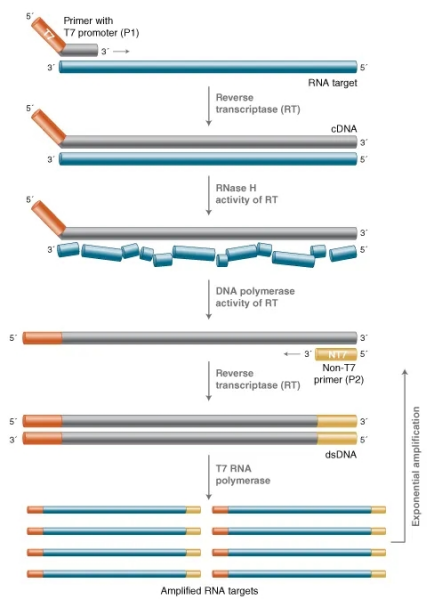
图7 转录介导的扩增原理(来源:网络)
数字PCR
Digital PCR,dPCR
数字PCR即三代PCR,是对原始PCR的另一种改进。通过终点检测计算目标序列的拷贝数,无需采用内参和标准曲线即可进行精确的绝对定量检测。终点检测不依赖于Ct值(循环阈值),受扩增效率的影响降低,对PCR反应抑制物的耐受能力提高,具有很高的准确度和重现性。此法对模板质量要求较高,模板量超过微体系量将导致无法定量,过少则定量准确度降低。当存在非特异性扩增时也会产生假阳性,所使用的仪器和试剂昂贵。
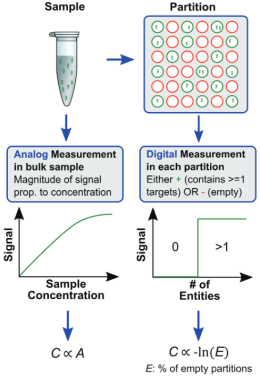
图8 数字PCR原理(来源:网络)
数字PCR通过其具备高灵敏度、高精确度的特点,不易被PCR反应抑制剂干扰,无需标准品可实现真正意义的绝对定量,仍旧成为研究和应用热点。根据反应单元的不同形式,主要可分为微流体式、芯片式和微滴式三大类系统。
04 临床意义
PCR技术是一种不可或缺的工具,广泛用于实验室和临床。常用来检测特定等位基因的存在,如夫妻双方在备孕期或孕早期筛查遗传病携带者的情况,可直接诊断疾病的存在和发育中胚胎的突变。文献指出PCR技术被首次用于检测单个基因突变诊断镰状细胞性贫血[7]。
此外,PCR技术极大地改变了传染病的诊断潜力,因为它可用来快速辨别难以培养或需要长周期生长的微生物[8] 。使用PCR技术进行常规检测发现的病原体包括结核分枝杆菌、人类免疫缺陷病毒、单纯性疱疹病毒、梅毒及其他病原体。此外,qPCR不仅用于检测微生物的定性存在,还可用于定量细菌、真菌及病毒载量[9]。
由于PCR技术的问世,对癌基因和肿瘤抑制基因突变的敏感性提高了至少10000倍,能更早地诊断白血病等癌症。PCR技术也为癌症患者提供了更精细且个性化的治疗。此外,PCR技术在各种遗传疾病或临床病理的产前检测领域也有较大影响[10]。
除以上介绍的几种PCR之外,PCR大家族还有热启动PCR(Hot start PCR)、巢式PCR (Nested PCR)、降落PCR (Touchdown PCR)、重叠延伸PCR (Gene splicing by overlap extension PCR,SOE PCR)、反向PCR (Inverse PCR, IPCR)、快速PCR (Fast PCR)、高GC含量PCR (GC-rich PCR)、长片段PCR (Long Range PCR)等技术。总之,改进的PCR实验方案和改进的DNA聚合酶旨在改善PCR扩增的结果。虽然PCR的基础概念并未发生改变,但新型PCR方法将继续推动和简化分子生物学研究。
参考文献
[1] Lee NY. A review on microscale polymerase chain reaction based methods in molecular diagnosis, and future prospects for the fabrication of fully integrated portable biomedical devices. Mikrochim Acta. 2018,185(6).
[2]N. Venkatesan, Y. Jun Seo and B. Hyean Kim,Quencher-free molecular beacons: a new strategy in fluorescence based nucleic acid analysis. Chem. Soc. Rev., 2008, 37, 648.
[3] Cao Y, Yu M, Dong G, et al. Digital PCR as an Emerging Tool for Monitoring of Microbial Biodegradation. Molecules. 2020,25(3).
[4] Soler M, Scholtz A, Zeto R, et al. Engineering photonics solutions for COVID-19. APL Photonics. 2020,5(9).
[5] Park J-W. Principles and Applications of Loop-Mediated Isothermal Amplification to Point-of-Care Tests. Biosensors. 2022; 12(10):857.
[6] Saiki RK, Scharf S, Faloona F, Mullis KB, Horn GT, Erlich HA, Arnheim N. Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. 1985. Biotechnology. 1992;24:476-80.
[7] Hill C S. Molecular diagnostic testing for infectious diseases using TMA technology. Exp Rev Mol Diagn, 2001,1(4):445-455.
[8] Mackay IM. Real-time PCR in the microbiology laboratory. Clin Microbiol Infect. 2004 Mar;10(3):190-212.
[9] Muldrew KL. Molecular diagnostics of infectious diseases. Curr Opin Pediatr. 2009 Feb;21(1):102-11.
[10] Ghannam, Mousa & Varacallo, Matthew. (2018). Biochemistry, Polymerase Chain Reaction (PCR).

